Enzym-Katalysatoren mit potentieller Anwendung bei der Herstellung wirksamer Pharmazeutika
Emeritus Prof. Reetz veröffentlicht gemeinsam mit fünf internationalen Forschergruppen eine fundamentale Studie in Nature Communications
Seit langem wissen pharmazeutische Chemiker, dass die Einführung von Hydroxylgruppen (OH) an bestimmten Positionen in natürlichen und synthetischen Steroiden die biologische Wirkung stark beeinflusst. Neue Anwendung in der Medizin ist daher denkbar, jedoch bleibt die Entwicklung von effizienten und allgemein gültigen Methoden zum notwendigen Sicherstellen von Regio- und Stereoselektivität eine enorme Herausforderung. Die unerwünschte Entstehung von schwer zu trennenden Produkt-Mischungen ist aus heutiger Sicht ökologisch und ökonomisch nicht zu tolerieren.
In einem 10 Jahre andauernden transdisziplinären Projekt unter Beteiligung von fünf internationalen Gruppen, wurde u.a. die Frage zur Interaktion von Selektivität und Aktivität eines biologischen Katalysators bei der Hydroxylierung von Steroiden experimentell und theoretisch angegangen. In einer vorangegangenen Studie hatten die Mitarbeiter um Professor Manfred T. Reetz eine Cytochrom P450 Monooxygenase genetisch verändert unter Bildung einer Tripel-Mutante mit drei Einzelmutationen, die es ermöglichte, Hydroxylgruppen regio- und stereoselektiv z. B. an der 2ß-Position von Steroiden oxidativ einzuführen. Diese Tripel-Mutante bildete nun den Ausgangspunkt für die neue Studie. Das Ziel war die Generierung von Information, die bei zukünftigen Projekten zur gezielten Hydroxylierung von Steroiden an beliebigen Positionen nützlich sein würde.
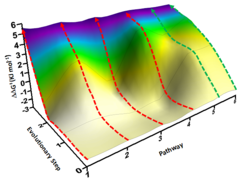
Zunächst wurden die entsprechenden drei möglichen Einzelmutanten, die das Tripel-Enzym charakterisieren, sowie alle theoretisch denkbaren Kombinationen (Dekonvulierung dieser Mutante) als neue Biokatalysatoren hergestellt und getestet. So konnten - gestützt von quanten-mechanischen Berechnungen - einmalige Einsichten über die P450-Katalyse gewonnen werden. Der Dekonvulierungs-Vorgang erlaubte es unter anderem alle sechs theoretisch möglichen evolutionären Wege vom Ausgangs-Enzym bis zur gleichen Tripel-Mutante als „Fitness-Landschaft“ experimentell zu konstruieren und daraus entscheidende Erkenntnisse zu gewinnen (s. Abbildung). Das Dekonvulierungs-Prozedere wurde von Reetz schon vor einigen Jahren für mechanistische Einblicke entwickelt, jetzt aber deutlich verfeinert und zum ersten Mal bei der schwierigen P450-katalysierten Steroid-Hydroxylierung angewendet. Dabei wurde auch die Beziehung zwischen Selektivität und Aktivität sichtbar.
Die Ergebnisse dieser Grundlagenforschung dürften bei zukünftigen Projekten über P450-katalysierte regio- und stereoselektive Hydroxylierung von Steroiden nützlich sein, so auch bei der zurzeit heiß erwünschten Entwicklung von C7-Selektivität.
Hier finden Sie den Link zum Artikel "Pervasive cooperative mutational effects on multiple catalytic enzyme traits emerge via long-range conformational dynamics".











